阿尔茨海默病是一种与年龄相关的神经退行性疾病,以进行性记忆与认知功能丧失为主要特征,其经典病理表现为β-淀粉样蛋白(Aβ)斑块沉积、神经原纤维缠结和神经元丢失。其中,Aβ斑块诱发的神经元死亡机制获得最广泛认可。尽管各类细胞死亡途径在神经元丢失中的具体作用仍存争议,但细胞凋亡确证参与AD病理进展过程。
2026年1月19日,厦门大学神经科学研究所冷历歌教授和张杰教授团队在Autophagy上发表题为“Metabolites released from apoptotic cells in central nervous system orchestrates the pathological process of Alzheimer disease through improving autophagy”的研究论文,通过分析不同凋亡刺激下原代神经元和胶质细胞的"分泌代谢组",鉴定出亚精胺作为中枢神经系统(CNS)中保守的凋亡代谢信使,通过旁分泌机制增强邻近细胞自噬流并改善阿尔茨海默病病理进程。

该研究团队从多个维度推进了相关领域的科研发展。首先,该团队的科研人员揭示了5×FAD小鼠大脑中Aβ诱导的细胞凋亡与自噬功能障碍(早期自噬体形成增强与后期自噬流阻断)的密切关联。既往关于自噬-凋亡相互作用的研究主要聚焦于细胞内信号通路的交叉对话。例如自噬通过清除受损细胞器、提供能量底物来维持细胞稳态以化解危机、阻止细胞凋亡;或当自噬过度激活时,可能选择性降解存活蛋白从而"协助"细胞走向凋亡死亡。然而这类视角忽视了细胞死亡作为多细胞事件,可释放信号分子扩散至周围环境并影响细胞微生态的可能性。该研究团队将视角从细胞内事件转向细胞间的通讯,首次揭示AD中枢神经系统中凋亡细胞并非沉默死亡,而是作为主动信号源,向微环境释放特定代谢信使。明确将亚精胺-一种已知多胺类物质-鉴定为CNS中不同细胞类型凋亡时共同释放的保守代谢信使。进而阐明亚精胺通过PANX1通道分泌,以旁分泌机制增强邻近细胞的自噬水平。这一发现不仅拓展了对凋亡-自噬交互作用复杂性的理解,更为细胞死亡微环境中适应性生存反应的形成机制提供了理论解释。
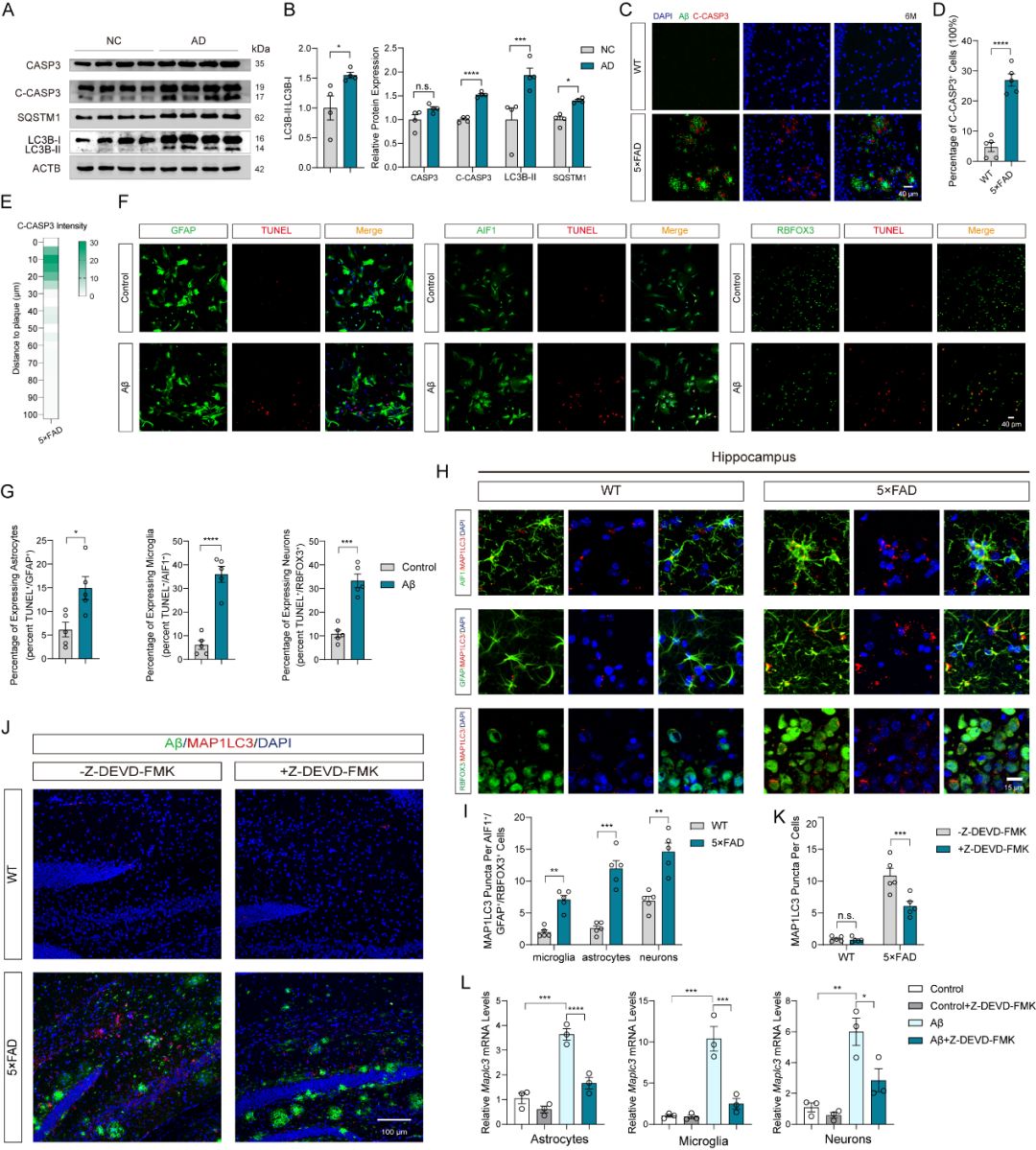
图1 在AD的病理过程中,细胞凋亡和细胞的自噬显著相关
其次,该研究团队鉴定出CNS凋亡细胞释放的保守代谢物-亚精胺,其释放具有跨细胞类型与刺激条件的普适性。这种保守特性可能源于凋亡细胞的代谢重编程(亚精胺的从头合成)以及caspase激活通道(PANX1)的开启。凋亡细胞并非等待清除的惰性残骸,而是通过释放代谢物作为"告别信号",主动调控组织内邻近细胞的多个基因程序。亚精胺作为CNS凋亡细胞的共性分泌代谢物,在向周围细胞传递凋亡信息方面发挥着极其重要的信使作用。其增强自噬、缓解AD病理进程的能力,为在AD治疗中利用凋亡的主动性有益性一面,提供了理论依据。

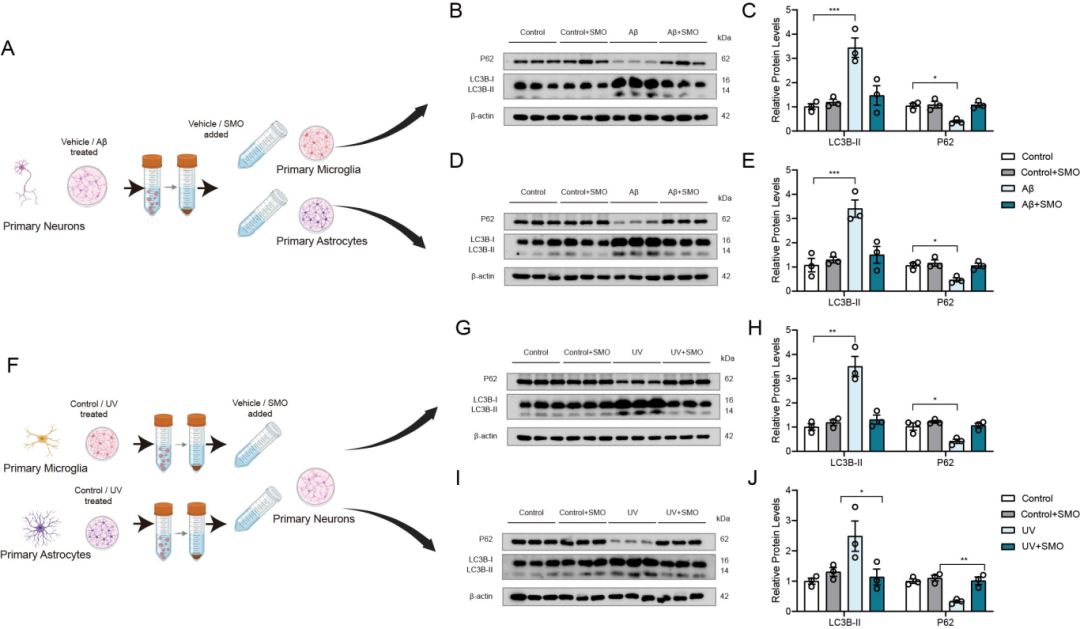
图2 亚精胺作为CNS保守的代谢信使,通过旁分泌的作用影响邻近细胞的自噬水平
第三,自噬过程通常可分为两个阶段:前期以自噬体形成为主,后期涉及自噬溶酶体形成及溶酶体内的降解过程。在AD患者及5×FAD小鼠脑组织中,该研究团队观察到自噬进程明显受损,特征为前期反馈性增强(LC3-II水平升高)与后期显著阻滞(SQSTM1大量累积)。值得关注的是,亚精胺能显著改善自噬流后期功能,体现为SQSTM1水平显著降低,从而缓解5×FAD小鼠的认知障碍。综上所述,该研究团队系统解析了CNS中保守的凋亡信使亚精胺,明确了AD中凋亡与自噬的关联性,并发现补充亚精胺可作为AD的潜在治疗策略。
厦门大学神经科学研究所冷历歌教授和张杰教授为本论文的通讯作者。同时,博士生肖繁,博士后谭雪和博士生贺澳杰为本论文的共同第一作者。本研究工作得到联合基金重点项目、国家重点研发计划项目、国家自然科学基金面上项目、中央高校基本科研业务费等的资助和支持。

