小胶质细胞是中枢神经系统(CNS)的固有免疫细胞,具有一定的自我更新能力,在大脑发育、稳态调节和疾病的发生发展中发挥着重要作用[1]。在正常发育生理条件下,小胶质细胞可通过吞噬作用参与突触修剪,从而形成正确的神经环路[2],并在成人大脑中通过分泌BDNF促进树突棘形成[3]。然而,在阿尔茨海默病(AD)大脑中,一些小胶质细胞亚群表现出营养不良和衰老特征[4],这些小胶质细胞可能通过生理功能受损或产生神经毒性,进而加剧AD进程。因此,清除和替代这些功能异常的小胶质细胞可能是治疗AD的一种新策略。
小胶质细胞的存活依赖于集落刺激因子1受体(CSF1R)的信号传导[5]。使用CSF1R抑制剂可高效诱导小胶质细胞消除[6],去除抑制剂后,小胶质细胞在较短时间内自我增殖并重新填满整个脑实质从而实现小胶质细胞更新[6,7]。这为评估小胶质细胞再殖对中枢神经系统疾病影响提供一种策略。CSF1R抑制剂PLX3397(也称为Pexidartinib)是FDA批准的用于治疗胶质母细胞瘤的药物。一些临床数据表明该药在人脑小胶质细胞耗竭方面具有很高的疗效[8]。因此,小胶质细胞更新和替换在人脑中似乎是可行的。最近的研究也表明,小胶质细胞再殖促进了小鼠损伤后大脑[9-11]以及衰老大脑的恢复[6]。然而,小胶质细胞再殖在AD背景下的影响及其潜在机制尚不完全清楚。
2023年7月21日,厦门大学神经科学研究所钟力副教授及陈小芬教授团队在Brain Behavior and Immunity上在线发表题为“Microglial repopulation reverses cognitive and synaptic deficits in an Alzheimer's disease model by restoring BDNF signaling”的研究论文。

该研究发现小胶质细胞再殖可逆转AD小鼠模型的突触和认知缺陷,并且阐明再殖小胶质细胞通过恢复BDNF信号传导进而发挥神经保护作用。这些发现揭示了小胶质细胞再殖在AD大脑中保护作用的相关机制,同时也为该癌症药物用于AD临床试验提供理论基础。
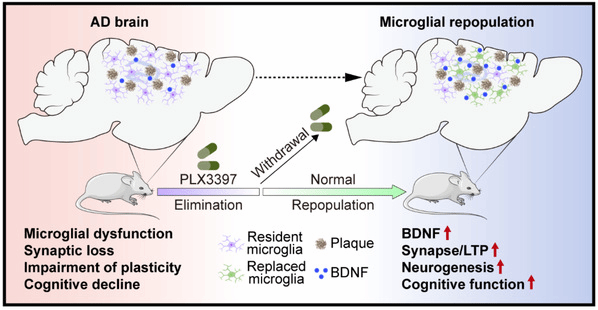
图1. 在AD大脑中,部分小胶质细胞表现营养不良和衰老特征,通过PLX3397消除小胶质细胞并停止使用该药后,再殖后的小胶质细胞通过提高5xFAD小鼠海马组织中BDNF的表达恢复突触可塑性、海马神经发生以及认知功能。
(原文链接:https://www.sciencedirect.com/science/article/pii/S0889159123002040)
厦门大学医学院神经科学研究所钟力副教授及陈小芬教授为本论文通讯作者,博士生王婉冰、硕士生栗延中及硕士生马芳玲为本文的共同第一作者。本研究得到Mayo Clinic卜国军教授大力支持,还得到了厦门大学张云武教授、郑红花教授、卓仁恭助理教授的帮助和宝贵意见。同时感谢厦大生物医学仪器平台的游翔、郑海萍、刘庆峰在仪器使用上的帮助。
参考文献:
[1] Bohlen C J, Friedman B A, Dejanovic B, Sheng M. Microglia in Brain Development, Homeostasis, and Neurodegeneration[J]. Annu Rev Genet 2019;53:263-288.
[2] Paolicelli R C, Bolasco G, Pagani F, Maggi L, Scianni M, Panzanelli P, Giustetto M, Ferreira T A, Guiducci E, Dumas L, Ragozzino D, Gross C T. Synaptic pruning by microglia is necessary for normal brain development[J]. Science 2011;333 (6048):1456-1458.
[3] Parkhurst C N, Yang G, Ninan I, Savas J N, Yates J R, 3rd, Lafaille J J, Hempstead B L, Littman D R, Gan W B. Microglia promote learning-dependent synapse formation through brain-derived neurotrophic factor[J]. Cell 2013;155 (7):1596-1609.
[4] Davies D S, Ma J, Jegathees T, Goldsbury C. Microglia show altered morphology and reduced arborization in human brain during aging and Alzheimer's disease[J]. Brain Pathol 2017;27 (6):795-808.
[5] Elmore M R, Najafi A R, Koike M A, Dagher N N, Spangenberg E E, Rice R A, Kitazawa M, Matusow B, Nguyen H, West B L, Green K N. Colony-stimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain[J]. Neuron 2014;82 (2):380-397.
[6] Elmore M R P, Hohsfield L A, Kramar E A, Soreq L, Lee R J, Pham S T, Najafi A R, Spangenberg E E, Wood M A, West B L, Green K N. Replacement of microglia in the aged brain reverses cognitive, synaptic, and neuronal deficits in mice[J]. Aging Cell 2018;17 (6):e12832.
[7] Huang Y, Xu Z, Xiong S, Sun F, Qin G, Hu G, Wang J, Zhao L, Liang Y X, Wu T, Lu Z, Humayun M S, So K F, Pan Y, Li N, Yuan T F, Rao Y, Peng B. Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion[J]. Nat Neurosci 2018;21 (4):530-540.
[8] Butowski N, Colman H, De Groot J F, Omuro A M, Nayak L, Wen P Y, Cloughesy T F, Marimuthu A, Haidar S, Perry A, Huse J, Phillips J, West B L, Nolop K B, Hsu H H, Ligon K L, Molinaro A M, Prados M. Orally administered colony stimulating factor 1 receptor inhibitor PLX3397 in recurrent glioblastoma: an Ivy Foundation Early Phase Clinical Trials Consortium phase II study[J]. Neuro Oncol 2016;18 (4):557-564.
[9] Li X, Gao X, Zhang W, Liu M, Han Z, Li M, Lei P, Liu Q. Microglial replacement in the aged brain restricts neuroinflammation following intracerebral hemorrhage[J]. Cell Death Dis 2022;13 (1):33.
[10] Rice R A, Pham J, Lee R J, Najafi A R, West B L, Green K N. Microglial repopulation resolves inflammation and promotes brain recovery after injury[J]. Glia 2017;65 (6):931-944.
[11] Willis E F, MacDonald K P A, Nguyen Q H, Garrido A L, Gillespie E R, Harley S B R, Bartlett P F, Schroder W A, Yates A G, Anthony D C, Rose-John S, Ruitenberg M J, Vukovic J. Repopulating Microglia Promote Brain Repair in an IL-6-Dependent Manner[J]. Cell 2020;180 (5):833-846 e816.

