阿尔茨海默症(Alzheimer’s disease, AD)是一种常见的神经退行性疾病,对患者的生活质量和健康构成了严重威胁。该疾病在临床前阶段存在一段无症状期,早期主要表现为记忆障碍和认知能力下降。随着疾病的发展,患者的运动能力、语言表达和空间方向感也会受到损害。由于社会人口的老龄化,AD的发病率和相关死亡率持续上升。《中国阿尔茨海默症报告》显示,从1990年至2019年,阿尔茨海默症在中国的疾病相关死亡率从第10位上升至第5位。
葡萄糖代谢率降低引起的神经细胞能量缺乏被认为是AD的重要病理特征之一,其调控机制尚待深入探究。β-羟基丁酰化是一种新型的蛋白质翻译后修饰,然而,蛋白质β-羟基丁酰化修饰是否参与AD的脑组织能量代谢尚不明确。
葡萄糖代谢率降低导致神经细胞能量不足,被认为是阿尔茨海默症(AD)的重要病理特征之一,其调控机制仍需深入研究。β-羟基丁酰化是一种新型的蛋白质翻译后修饰,但其是否参与AD脑组织能量代谢尚不明确。
2024年10月16日,厦门大学神经科学研究所的张云武教授团队与附属第一医院的王占祥教授团队合作在《Aging Cell》(IF:8.0/Q1 TOP)在线发表了题为“Ketogenic β-hydroxybutyrate regulates β-hydroxybutyrylation of TCA cycle-associateed enzymes and attenuates disease-associated pathologies in Alzheimer’s mice”的论文,阐述了生酮饮食如何通过β-羟基丁酰化这一新型蛋白质翻译后修饰,调节神经元的能量代谢,从而改善APP/PS1小鼠病理表型的分子机制。

研究团队分析了AD模型小鼠APP/PS1与野生型小鼠脑组织中β-羟基丁酸(BHB)的浓度,结果显示APP/PS1小鼠脑组织中BHB浓度显著低于野生型小鼠。这一发现提示蛋白质的β-羟基丁酰化修饰可能参与AD的发生和发展。因此,研究人员进一步进行了β-羟基丁酰化蛋白质组织学分析。
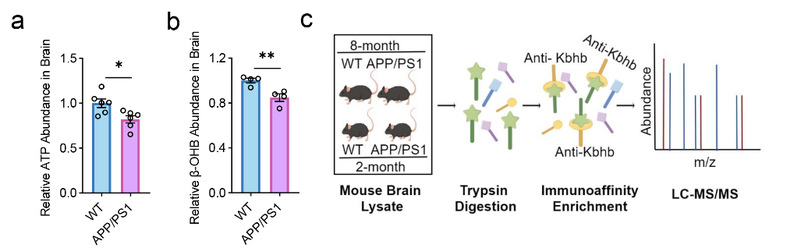
图1. APP/PS1小鼠脑组织中BHB浓度降低
研究人员通过β-羟基丁酰化修饰组学分析及验证,发现SUCLG1的β-羟基丁酰化修饰水平降低与疾病的发生相关,而CS的β-羟基丁酰化修饰水平降低则与疾病的发展相关。通过Na-β-OHB处理可以提高其修饰水平,从而改善酶活性并增加ATP的产生。
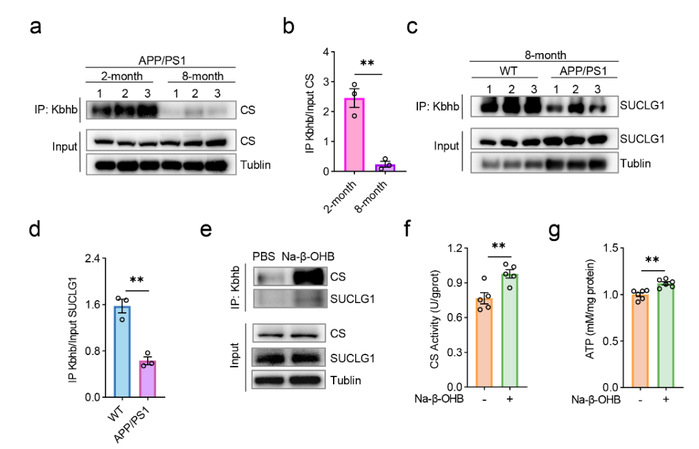
图2. CS和SUCLG1的β-羟基丁酰化修饰降低与APP/PS1小鼠疾病发生发展相关
生酮饮食是增加体内β-羟基丁酰化底物BHB的有效方式。研究人员对APP/PS1小鼠进行了为期三个月的生酮饮食,结果显示生酮饮食显著诱导了神经元中β-羟基丁酰化修饰水平的增加。
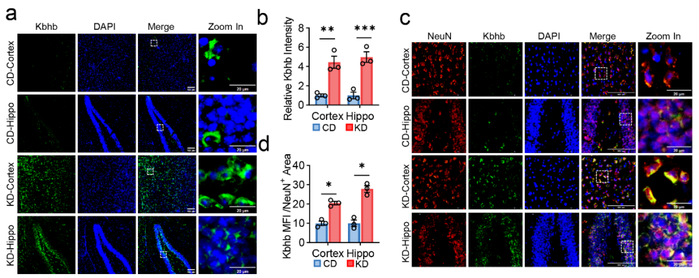
图3.生酮饮食增加APP/PS1小鼠神经元β-羟基丁酰化修饰水平
考虑到脑组织ATP缺乏是AD的重要病因,研究人员进一步分析了生酮饮食后APP/PS1小鼠的疾病相关病理表型是否有所改善。结果发现,生酮饮食显著抑制了Aβ斑块的沉积和小胶质细胞增生,表明生酮饮食具有改善AD的潜能。
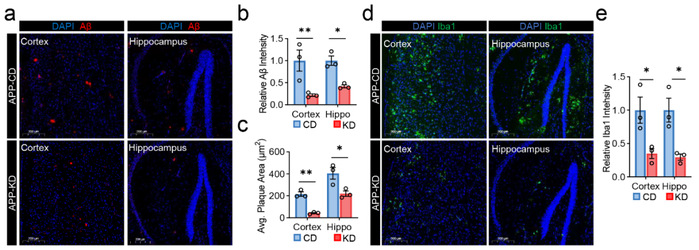
图4.生酮饮食(KD)治疗可减轻APP/PS1小鼠病理
总之,在该研究中,团队研究人员使用APP/PS1小鼠,借助蛋白质β-羟基丁酰化蛋白质组学技术,鉴定出CS和SUCLG1的β-羟基丁酰化失调是AD小鼠脑组织ATP缺乏的重要因素。生酮饮食通过上调APP/PS1小鼠神经元中CS和SUCLG1的β-羟基丁酰化,促进三羧酸循环及ATP生成,从而缓解AD的病理表型。这项研究为生酮饮食对AD的潜在治疗功能提供了新的分子机制。

