神经突触修剪和消除是中枢神经系统发育和功能塑造的重要过程,涉及到多种细胞和分子的相互作用,其中包括小胶质细胞和补体系统的参与。小胶质细胞作为大脑中主要的免疫细胞对突触进行重塑:在发育阶段消除功能弱的突触形成正确的神经环路,在病理状态下小胶质细胞异常吞噬突触引起认知功能障碍1。TREM2是属于免疫球蛋白超家族的跨膜受体,在中枢神经系统中其特异性表达于小胶质细胞。TREM2编码区的R47H突变增加罹患阿尔茨海默病(AD)的风险高达4.5倍,因此TREM2已被确认为AD的最强免疫特异性遗传风险因素之一2。
TREM2能够结合apoE、Aβ、galectin-3、TDP-43等多种配体,在小胶质细胞存活、增殖、吞噬、迁移以及炎症反应等功能维持中发挥重要作用3。进一步的研究表明,TREM2在发育早期的突触修剪过程中发挥重要的调节作用,TREM2的突变或功能缺失会导致神经突触修剪异常,进而影响正常的神经回路形成4,5。突触丢失是AD早期的一个重要病理特征,与认知功能损害的严重程度密切相关。在AD动物模型的研究中发现,小胶质细胞和补体通路在AD脑中被异常激活,导致小胶质细胞对神经突触过度修剪进而造成突触丢失6。尽管TREM2参与早期发育阶段小胶质细胞介导的突触修剪已被报道,但TREM2在AD背景下是否以及如何调节小胶质细胞介导的突触消除仍不清楚。
2023年7月12日,厦门大学神经科学研究所陈小芬教授和钟力副教授团队在Immunity上在线发表题为TREM2 receptor protects against complement-mediated synaptic loss by binding to complement C1q during neurodegeneration的研究论文。

该研究揭示了TREM2作为一种新型的补体抑制剂,通过高亲和力地结合补体起始因子C1q从而阻断补体通路的激活,减少补体介导的小胶质细胞对突触的吞噬和消除,最终在AD病理环境中参与神经突触稳态的维持。这些研究结果揭示了AD重要风险基因TREM2在神经退行性变过程中限制补体介导的突触消除的关键作用,为理解TREM2对抗AD发病机制的保护作用提供了新的机制见解。这些研究为深入理解AD的发病机制以及开发新的治疗策略提供了新思路。
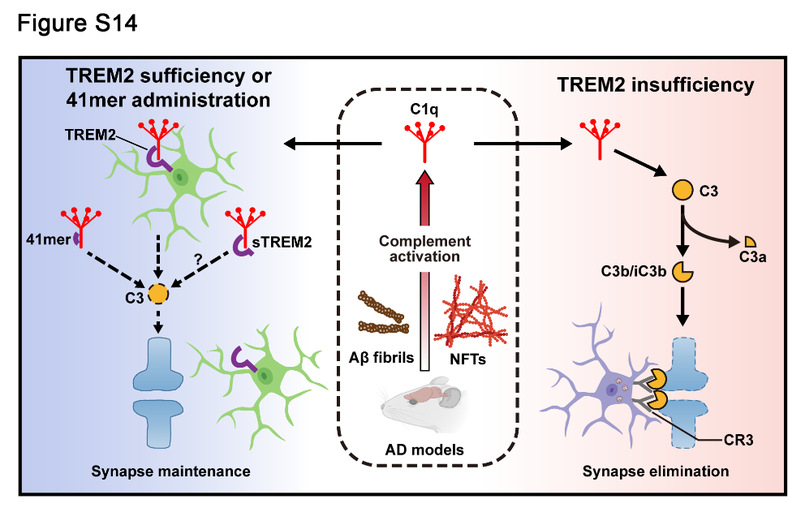
图1. TREM2通过高亲和力地结合补体起始因子C1q从而抑制AD大脑中过度激活的补体通路,减少补体介导的小胶质细胞对突触的吞噬和消除,最终在AD病理环境中参与神经突触稳态的维持。当TREM2蛋白水平不足时,补体通路的过度激活促进小胶质细胞对突触的异常吞噬,从而导致突触的大量丢失。通过补充TREM2多肽(41mer)可抑制补体激活并修复突触稳态。

厦门大学神经科学研究所陈小芬教授和钟力副教授为本论文通讯作者,钟力副教授、博士后盛璇、博士生王婉冰、硕士生栗延中、助理教授卓仁恭、硕士生王恺(已毕业)为本文的共同第一作者。本研究得到了Mayo Clinic卜国军教授、福建医科大学陈晓春教授以及厦门大学张云武教授和王鑫教授的帮助和宝贵建议,中南大学湘雅医学院严小新教授为本文研究提供了重要的患者样品。本研究还得到了清华大学葛亮研究员、重庆医科大学王超教授、厦门大学吴彩胜教授、华中科技大学附属协和医院教授胡德胜教授、西湖大学黄晶研究员等的大力支持与帮助。
(原文链接:https://doi.org/10.1016/j.immuni.2023.06.016)
参考文献:
1. Dalakas, M.C., Alexopoulos, H., and Spaeth, P.J. (2020). Complement in neurological disorders and emerging complement-targeted therapeutics. Nat Rev Neurol 16, 601-617. 10.1038/s41582-020-0400-0.
2. Deczkowska, A., Weiner, A., and Amit, I. (2020). The Physiology, Pathology, and Potential Therapeutic Applications of the TREM2 Signaling Pathway. Cell 181, 1207-1217. 10.1016/j.cell.2020.05.003.
3. Colonna, M. (2023). The biology of TREM receptors. Nat Rev Immunol, 1-15. 10.1038/s41577-023-00837-1.
4. Filipello, F., Morini, R., Corradini, I., Zerbi, V., Canzi, A., Michalski, B., Erreni, M., Markicevic, M., Starvaggi-Cucuzza, C., Otero, K., et al. (2018). The Microglial Innate Immune Receptor TREM2 Is Required for Synapse Elimination and Normal Brain Connectivity. Immunity 48, 979-991 e978. 10.1016/j.immuni.2018.04.016.
5. Jadhav, V.S., Lin, P.B.C., Pennington, T., Di Prisco, G.V., Jannu, A.J., Xu, G., Moutinho, M., Zhang, J., Atwood, B.K., Puntambekar, S.S., et al. (2020). Trem2 Y38C mutation and loss of Trem2 impairs neuronal synapses in adult mice. Mol Neurodegener 15, 62. 10.1186/s13024-020-00409-0.
6. Hong, S., Beja-Glasser, V.F., Nfonoyim, B.M., Frouin, A., Li, S., Ramakrishnan, S., Merry, K.M., Shi, Q., Rosenthal, A., Barres, B.A., et al. (2016). Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science (New York, N.Y.) 352, 712-716. 10.1126/science.aad8373.

